Της Ιωάννα Θεοδώρου, PhD
Ερευνήτρια σε μεταδιδακτορικό πρόγραμμα
του Ινστιτούτου Παστέρ στο Παρίσι
Ο καρκίνος αντιπροσωπεύει ένα από τους κύριους παράγοντες θνησιμότητας σε παγκόσμιο επίπεδο με 14 εκατομμύρια νέα «κρούσματα» στοιχίζοντας τη ζωή σε περίπου 8,2 εκατομμυρια ανθρώπους (World Cancer Report 2014 από τον Παγκόσμιο Οργανισμό Υγείας). Ο ΠΟΥ υπολογίζει επίσης πως τα επόμενα 20 χρόνια αυτός ο αριθμός ενδέχεται να αυξηθεί κατά 70% (http://www.who.int/mediacentre/factsheets/fs297/en/).
Πρόσφατα, ένας από του πιο «ελκυστικούς» και γρήγορα αναπτυσσόμενους ερευνητικούς τομείς για αντιμετώπιση του καρκίνου αφορά το σχεδιασμό και τον χαρακτηρισμό νανοσωματιδίων και νανο-ιατρικών υλικών. Ο υβριδικός αυτός τομέας που ονομάστηκε Νανοϊατρική (Nanomedicine), είναι ουσιαστικά η εφαρμογή της νανοτεχνολογίας στην ιατρική. Η νανοΐατρική εκτείνεται από τις ιατρικές εφαρμογές μικροσκοπικών βιο-αισθητήρων (biosensors) μέχρι τον σχεδιασμό νανοϋλικών για βελτιωμένη διάγνωση και θεραπεία όχι μόνο του καρκίνου αλλά και άλλων ασθενειών. Ένα μεγάλο τμήμα της νανοϊατρικής αφορά την ανάπτυξη νανοσυστημάτων τα οποία φέρουν την δυνατότητα να παραδώσουν ταυτοχρόνως φαρμακευτικά παρασκευάσματα για θεραπεία παθολογικών σημείων και διάφορα στοιχεία για τον καλύτερο εντοπισμό τους από διάφορες μεθόδους μοριακής απεικόνισης.
Κίνητρα πίσω από την ανάπτυξη νανοσυστημάτων για την αντιμετώπιση του καρκίνου.
Όταν ένα φάρμακο χορηγείται στον οργανισμό, αντιμετωπίζει διάφορα εμπόδια τα οποία περιορίζουν την αποτελεσματική του δράση, αφού θα πρέπει πρώτα να διαπεράσει διαφορετικά βιολογικά φράγματα όπως η εντερική βλεννογόνος, τα αγγειακά διαφράγματα και η κυτταρική μεμβράνη. Επίσης πολλά φάρμακα έχουν χαμηλές χημικές σταθερότητες και σύντομη ημιζωή στον οργανισμό, με αποτέλεσμα την πολύ γρήγορη εξάλειψή τους πριν να ολοκληρωθεί η δράση τους. Επιπλέον, τα καρκινικά κύτταρα έχουν τη δυνατότητα να αναπτύσσουν μηχανισμούς αντίστασης σε πολλά από τα αντικαρκινικά φάρμακα. Ένας από τους κυρίους όμως λόγους πίσω από την ανάπτυξη νανοσυστημάτων για τον καρκίνο βρίσκεται στο γεγονός ότι τα αντικαρκινικά φάρμακα έχουν περιορισμένη επιλεκτικότητα με αποτέλεσμα να συσσωρεύονται σε διάφορους υγιείς ιστούς και να προκαλούν μια πληθώρα παρενεργειών όπως ναυτίες, απώλεια μαλλιών κτλ. Για αυτό το λόγο η βελτίωση της επιλεκτικότητας παράδοσης αντικαρκινικών σε παθολογικούς όγκους είναι εξαιρετικής σημασίας.
Κατά την περίοδο των τελευταίων ετών, η νανοιατρική έχει συνεισφέρει στην ανάπτυξη νανοσωματιδίων, όρου που χρησιμοποιείται για να περιγράψει υλικά των οποίων οι δομές έχουν μήκη από 0.1 μέχρι μερικών εκατοντάδων νανομέτρων (1 nm = 10-9 m. Τα νανοσωματίδια αυτά παρουσιάζουν ήδη μεγάλες προοπτικές για την καλύτερη διανομή αντικαρκινικών σε όγκους, αυξάνοντας έτσι την αποτελεσματικότητά τους και μειώνοντας ταυτοχρόνως τις παρενέργειες. Τα νανοσωματίδια που αναπτύχθηκαν για την ιατρική, έχουν συγκεκριμένα χαρακτηριστικά όπως νανομετρικό μέγεθος, μεγάλη επιφάνεια ως προς τον συνολικό όγκο και επιθυμητές φυσικό-χημικές ιδιότητες. Ονομάζονται συχνά νανο-μεταφορείς γιατί φέρουν είτε φαρμακευτικά παρασκευάσματα είτε στοιχεία για μοριακή απεικόνιση είτε και τα δυο ταυτόχρονα. Για την παρασκευή τους χρησιμοποιούνται διάφορα υλικά όπως δείχνει η Φιγούρα 1, τα οποία έχουν αισθητά χαμηλότερο κόστος απ’ ότι τα ίδια τα αντικαρκινικά φάρμακα. Τα υλικά αυτά είναι επίσης σχεδιασμένα για να τροποποιούν τα φαρμακο-κινητικά και φαρμακο-δυναμικά προφίλ διαφόρων αντικαρκινικών, αυξάνοντας έτσι την φαρμακευτική τους δυνατότητα. Συμπερασματικά, όταν διάφοροι νανο-φορείς συμπληρώνονται με αντικαρκινικά, αυτά έχουν αυξημένη ημιζωή και περιφέρονται για περισσότερο χρόνο στο κυκλοφορικό σύστημα με αποτέλεσμα την συγκεκριμένη και ελεγχόμενη αποδέσμευσή τους σε παθολογικούς και μόνο ιστούς.
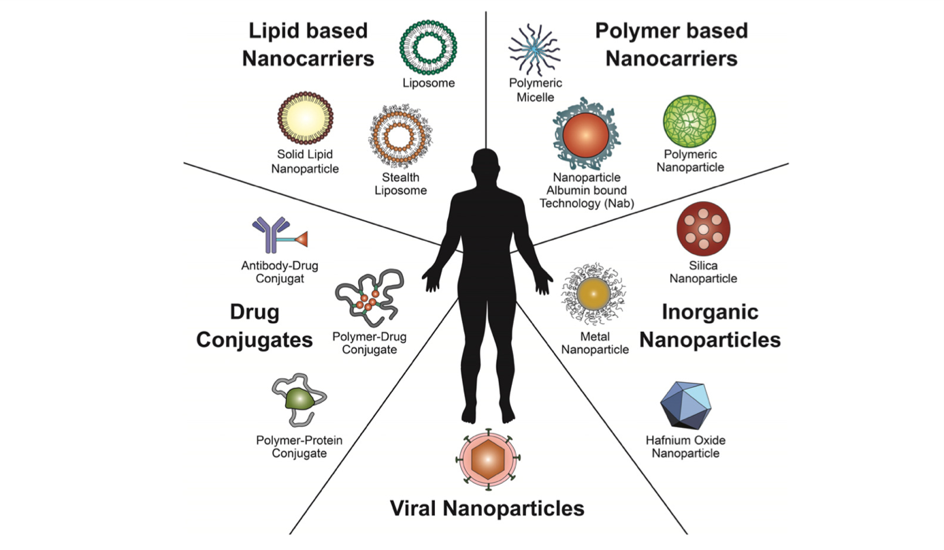
Φιγούρα 1. Εικονογράφηση διάφορων νανοθεραπευτικών πλατφόρμων όπως συζεύγματα φαρμάκων με πρωτεΐνες ή αντισώματα, νανοφορείς με βάση λιπίδια, πολυμερικά νανοσωματίδια, ανόργανα νανοσωματίδια και νανοσωματίδια ιών που χρησιμοποιούνται σήμερα στην κλινική (Wicki, Witzigmann et al., 2015).
Υπάρχουν επιπλέον διάφορα ιατρικά και κοινωνικά κίνητρα υπέρ της ανάπτυξης νανο-θεραπευτικών σκευασμάτων.
Ιατρικά κίνητρα
Πολλά από τα αντικαρκινικά φάρμακα υποφέρουν από φτωχή διαλυτότητα και χημική σταθερότητα με αποτέλεσμα την περιορισμένη βιοδιαθεσιμότητα τους στον οργανισμό. Τα νανοσωματίδια μπορούν να βοηθήσουν αποτελεσματικά στην καλυτέρευση της βιοδιαθεσιμότητας τους με την ενθυλάκωση υδροφοβικών φαρμάκων σε υδρόφιλα νανοϋλικά. Για παράδειγμα, η ανάπτυξη του φαρμάκου Wortmannin, είχε σταματήσει λόγω της χαμηλής του διαλυτότητας και της υψηλής του τοξικότητας. Παρόλα αυτά, η ενθυλάκωση του σε λιποειδή νανοφορείς κατάφερε να αυξήσει τη διαλυτότητα της wortmannin από 4 mg/L στα 20 mg/L και να μειώσει την τοξικότητά της κατά 3 με 5 φορές.
Σήμερα, αρκετοί νανοφορείς έχουν περάσει από κλινικές δοκιμές και μερικοί έχουν ήδη εγκριθεί για αγωγή σε ασθενείς με διαφορετικούς τύπους καρκίνου, με αξιοσημείωτα παραδείγματα το Doxil® και το Abraxane®. Οι συγκεκριμένοι νανοφορείς είναι σε θέση να αλλάξουν τη βιο-κατανομή και τη στόχευση των φαρμάκων, επιτρέποντάς τους να συσσωρεύονται κατά προτίμηση στην εγγύτητα του όγκου. Ο βιολογικός μηχανισμός που ευθύνεται για την παράδοση των νανοσωματιδίων είναι εξαιρετικά πολύπλοκος : Τα παθο-φυσιολογικά χαρακτηριστικά των καρκίνων και το περιβάλλον τους έχουν αξιοποιηθεί για παθητική στόχευση των νανοσωματιδίων. Συγκεκριμένα, οι Matsumura και Maeda (Matsumura και Maeda 1986), το 1986, διερεύνησαν, περιέγραψαν και επικύρωσαν αυτά τα χαρακτηριστικά λεπτομερώς αρκετές φορές. Αυτές οι μελέτες έδειξαν ότι οι περισσότεροι συμπαγείς όγκοι έχουν αιμοφόρα αγγεία με ελαττωματική αρχιτεκτονική. Ως αποτέλεσμα, το ενδοθηλιακό αιμοφόρο αγγείο διέπετε με μεγάλα διάκενα μεγέθους μεταξύ 100 nm και 780 nm και έως 2 μm. Επιπλέον, οι όγκοι έχουν ελαττωματική λεμφική λειτουργία. Ο συνδυασμός αυτών των δύο φαινομένων ονομάστηκε στα αγγλικά ως Enhanced Permeability and Retention effect (EPR). Η αγγειακή διαπερατότητα εξασφαλίζει επίσης επαρκή παροχή θρεπτικών ουσιών και οξυγόνου στους καρκινικούς ιστούς για ταχεία ανάπτυξη. Ταυτόχρονα, παρατηρήθηκε ότι η επίδραση του EPR δεν εμφανίζεται σε φυσιολογικούς ιστούς. Η χορήγηση νανοσωματιδίων από το σημείο της ένεσης στα σημεία στόχευσης εντός ενός όγκου περιλαμβάνει πολλαπλά κινητικά βήματα που ξεκινούν με τη μεταφορά τους μέσω της κυκλοφορίας, εξαγγείωση από το αγγειακό σύστημα και διάμεση μεταφορά, δέσμευση στην κυτταρική μεμβράνη, εσωτερίκευση και τελικά ενδοκυτταρική διακίνηση. Επιπλέον, η μεταφορά νανοσωματιδίων σε έναν συμπαγή όγκο δεν οδηγείται μόνο από φυσιολογικούς παράγοντες όπως η διάχυση μέσω αγγείων, η λεμφική αποστράγγιση και η πίεση του διάμεσου υγρού του όγκου (IFP), αλλά και από τις φυσικοχημικές τους ιδιότητες. Αυτές οι ιδιότητες περιλαμβάνουν επιφανειακά χαρακτηριστικά (φορτίο και υδροφιλικότητα) και μέγεθος σωματιδίων μεταξύ άλλων.
Κοινωνική σημασία
Η ανακάλυψη του EPR θεωρήθηκε ως μία από τις μεγαλύτερες επιτυχίες για τη θεραπεία κατά των καρκινικών όγκων. Συνεπώς, είναι μια αρχή ορόσημο στη χημειοθεραπεία, στοχεύοντας καθαρά κακοήθεις όγκους και οφείλει να χρησιμοποιείται πλέον όλο και περισσότερο ως πρότυπο για την ανάπτυξη αντικαρκινικών φαρμάκων. Παράλληλα, είναι πολύ σημαντικό να αναφερθεί για άλλη μια φορά ότι τα υλικά που χρησιμοποιούνται για την σύνθεση των νανοσωματιδίων είναι βιο-συμβατά και πολύ φτηνότερα από τα αντικαρκινικά φάρμακα. Μειώνουν συνολικά την συγκέντρωση ή δόση των αντικαρκινικών σκευασμάτων προστατεύοντας τα ταυτοχρόνως (μέσω της ενθυλάκωσης τους από τα νανοσωματίδια) από την γρήγορη εξάλειψη τους από τον οργανισμό και αποτρέποντας τη συσσώρευσή τους σε υγιείς ιστούς. Οι ασθενείς επομένως ανέχονται και διαχειρίζονται πολύ καλύτερα τις χημειοθεραπείες τους αφού οι παρενέργειες μειώνονται σημαντικά.
Λαμβάνοντας λοιπόν υπόψη τις ιδιότητες των νανοσωματιδίων για ελεγχόμενη αποδέσμευση σε καρκινικούς και μόνο ιστούς μέσω του EPR χρησιμοποιώντας φτηνά υλικά, κάποιος καταλαβαίνει γρήγορα ότι το κόστος των αντικαρκινικών θεραπειών θα μπορεί να μειωθεί αισθητά, ανακουφίζοντας σημαντικά τα έξοδα των καρκινοπαθών, αλλά βοηθώντας ταυτοχρόνως τα δημόσια νοσοκομεία στη διαχείριση της ασθένειας αυτής.
Υπάρχει επομένως ανάγκη για προαγωγή της έρευνας, μελέτης και εφαρμογής της νανοτεχνολογίας στην ιατρική από δημόσια εργαστήρια και πανεπιστημιακά νοσοκομεία, στηριζόμενα από κυβερνητικές χρηματοδοτήσεις για αποφυγή εκμετάλλευσης αυτής της τεχνολογίας από μεγάλες ιδιωτικές φαρμακευτικές εταιρίες οι οποίες θα προτείνουν θεραπείες βασισμένες στη νανοτεχνολογία που θα είναι προσβάσιμες μόνο σε ένα μικρό κομμάτι της κοινωνίας και όχι στο σύνολό της.
*Άρθρο που κυκλοφόρησε στη "Ν" Μαρτίου




